Livello di energia
- I livelli di guscio elettronico o di energia saranno le distanze specificate dal nucleo di un atomo in cui potrebbero essere trovati gli elettroni o la più alta probabilità di essere trovati. Gli elettroni sono particelle caricate negativamente all'interno di una molecola che si muovono attorno al nucleo positivo, solitamente situato al centro. I livelli di energia sono un po 'come le misure dei salti di elettroni di un gradino.
- Nella maggior parte dei concetti fondamentali di un atomo; sono costituiti da elettroni che orbitano attorno a un nucleo.
- Tuttavia, gli elettroni non sono in grado di scegliere un'orbita secondo il loro desiderio. Gli elettroni sono limitati alle orbite con solo un certo livello di energia. Gli elettroni sono solo in grado di saltare da un livello di energia o passare a un altro livello. Gli elettroni non possono orbitare con energie diverse dai livelli di energia specificati.
Qual è il diagramma del livello di energia?
Livello di energia significa valutare la quantità di energia che l'elettrone può richiedere e sarà rilasciato durante la transizione, se salta da un'orbita all'altra. Lo stato fondamentale o zero è lo stato energetico minimo calcolato per H.2 molecole.

Quali sono i quattro livelli di energia?
Esistono quattro tipi di orbitali: s, p, d e f.
- Sharp-s
- Principio-p
- Diffusa-d
- Fondamentale-f
In un atomo, ci sono alcune combinazioni di questi orbitali.
Il livello di energia è una quantità di spazio o regioni, ovunque elettroni probabilmente sarà presente. Queste distanze, note come orbitali, sono di forme diverse, indicate da una lettera (s, p, d, f).

Geek3, Nuvole-orbitali-atomiche spdf m0, CC BY-SA 4.0
Come si determinano i livelli di energia?

Bruce Blaus, Blausen 0342 livelli di energia elettronica, CC BY 3.0
elettroni di valenza
"Gli elettroni quelli che si trovano nel livello di energia più alto sono chiamati elettroni di valenza."
Stato fondamentale
“Lo stato di equilibrio energetico minimo dell'H2 l'atomo è riconosciuto come lo stato fondamentale. "
Stato eccitato
Quando l'elettrone (o l'atomo) ha un'energia superiore a questa energia più bassa, si dice che sia in uno "stato eccitato".
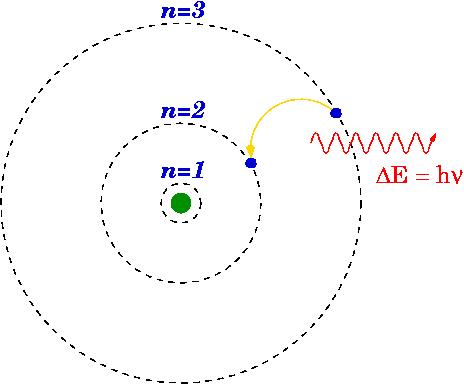
Se un elettrone scende da un livello superiore a uno inferiore, un fotone può emettere o l'energia viene rilasciata.
Differenza energetica
L'energia del fotone emesso è la differenza tra i livelli di energia del primario (n i ) e finale (n f ) stato. L'energia del fotone emesso viene calcolata utilizzando la formula di Rydberg.
Il modello di Bohr dell'idrogeno
Nel 1913, Niels Bohr concettualizzò i livelli di energia e la frequenza spettralen dell'H2 nel considerare vari semplici presupposti per fissare l'ipotetico classico. La maggior parte di questi difetti sono stati risolti dalla modifica di Arnold Summerfield del modello Bohr. Per questo modello, il fisico Niels Bohr ha ricevuto il Premio Nobel per la fisica nell'anno 1922.
Nel concetto fondamentale che un atomo (il modello atomico di Bohr), gli elettroni ruotano solo determinate orbite attorno al nucleo. Gli elettroni che scendono e salgono tra le orbite consentite, oltre all'emissione o all'assorbimento di energia, avvengono.
Sebbene questo modello di base non sia accettato bene perché la maggior parte della struttura degli atomi è più complicata dell'idrogeno, sebbene ciò richieda i nuovi soggetti, da qui l'introduzione della meccanica quantistica, nella meccanica quantistica, ogni elettrone orbitante è spiegato da un'espressione matematica nota come una funzione d'onda.
Willow W., Modello atomico di Bohr, CC BY-SA 3.0
raggio di Bohrhr
"Il raggio di Bohr (a0) è un parametro costante, è uguale alla distanza più prevedibile per l'atomo di idrogeno tra il nucleo e l'elettrone allo stato fondamentale (non relativistico e avente un protone infinitamente pesante)"
Prende il nome da Niels Bohr a causa della sua parte nel modello di Bohr di un atomo.

SE3-29X, GIF idrogeno, CC BY-SA 4.0
Linee spettrali
Ogni componente ha un particolare insieme di livelli di energia. Pertanto, le frequenze in cui assorbe ed emette luce si comportano come una sorta di microfono, identificando il composto specifico e particolare. Queste caratteristiche degli atomi hanno permesso di indagare in soggetti chiamati spettroscopia, una scienza dedicata all'identificazione di molecole e atomi dal tipo di radiazione che assorbono o emettono.
Serie Balmer
Il fisico atomico Balmer ha osservato analiticamente una relazione nelle energie durante il rilascio di fotoni dall'atomo. Le varie energie / lunghezze d'onda discrete dei fotoni scoperte da Balmer sono chiamate serie di Balmer.
In seguito si è saputo che le transizioni di energia creano le linee di Balmer dall'atomo di idrogeno. Il modello di Bohr dell'atomo è riuscito a definire la serie di Balmer perché orbite più grandi avevano bisogno di elettroni per avere una potenza significativamente maggiore o energia negativa per bilanciarsi con il momento angolare. La formula Rydberg offre una visione ampia della serie Balmer per tutte le regolazioni del livello energetico.
Spettro di emissione
I spettro di emissione dell'idrogeno atomico è stato suddiviso in numerose serie spettrali e lunghezze d'onda fornite dalla formula standard di Rydberg. Queste righe spettrali rilevate sono il risultato della transizione elettronica da diversi livelli di energia in un atomo.
Uno spettro di emissione denota la varietà di lunghezze d'onda emesse da un atomo o un composto chimico stimolato dal riscaldamento o dalla corrente elettrica. Lo spettro di emissione del gas che brucia o di altre molecole potrebbe anche essere utilizzato per istanziare la sua composizione.
Immagine di credito: Ranjithsiji, Spettro di emissione atomica dell'elio, CC BY-SA 4.0
Energia potenziale
“Questa è l'energia di un'entità per la sua posizione rispetto ad altri oggetti, sollecitazioni, carica elettrica immagazzinata o altri fattori dentro di sé. "
Energia di legame
"L'energia di legame è l'energia minima richiesta per tenere insieme un nucleo."
Energia ionizzata
"La quantità di energia che un atomo isolato nello stato elettronico fondamentale ha richiesto di essere assorbito per essere scaricato come e- "
L'energia di ionizzazione è descritta come una fase di difficoltà nel rimuovere un elettrone in un atomo o ione o la capacità di un atomo o ione di cedere un elettrone. Il no della riduzione degli elettroni di solito si verifica nello stato fondamentale della specie.
Le energie di ionizzazione sono misurate in kJ / mol, o la quantità di energia necessaria per tutti gli atomi in una mole per allentare l'unità e- rispettivamente.
Come funziona l'energia di ionizzazione?
L'energia di ionizzazione è l'energia richiesta, in cui un atomo gassoso isolato dallo stato elettronico fondamentale dovrebbe assorbire per rilasciare un elettrone. Più elettroni sono persi, più + ve sarà questo ione e sarà più difficile separare l'e- dall'atomo.
Quale elemento ha l'energia di ionizzazione più alta e più bassa?
- L'elemento Ha la più alta energia di ionizzazione.
- Il Francium ha la minima energia di ionizzazione.
L'energia di ionizzazione di un elemento diventa più alta da sinistra a destra attraverso una tavola periodica e diminuisce dall'alto verso il basso generalmente nella tavola periodica.
Cdang ed Adrignola, Tavola periodica dell'energia di ionizzazione, CC BY-SA 3.0
Per ulteriori informazioni sulla nuvola di elettroni CLICCA QUI
Leggi anche:
- L'energia potenziale è energia immagazzinata?
- Tipi di energia cinetica
- Esempio di energia elettrica ad energia radiante
- Esempio di trasformazione dell'energia meccanica in quella elettrica
- Dall'energia gravitazionale all'energia meccanica
- Formula dell'energia eolica
- La massa influisce sull'energia potenziale
- Dall'energia radiante all'energia chimica
- Dall'energia chimica all'energia sonora
- Esempio di energia cinetica-sonora

Sono Subrata, Ph.D. in Ingegneria, più specificatamente interessato ai settori legati alle scienze nucleari ed energetiche. Ho esperienza multi-ambito, dal tecnico dell'assistenza per azionamenti elettronici e microcontrollori al lavoro specializzato di ricerca e sviluppo. Ho lavorato su vari progetti, tra cui la fissione nucleare, la fusione con il solare fotovoltaico, la progettazione di riscaldatori e altri progetti. Nutro un vivo interesse per il settore scientifico, l'energia, l'elettronica e la strumentazione e l'automazione industriale, principalmente a causa dell'ampia gamma di problemi stimolanti ereditati da questo campo, che ogni giorno cambia con la domanda industriale. Il nostro obiettivo qui è quello di esemplificare questi argomenti scientifici non convenzionali e complessi in modo semplice e comprensibile.

Ciao amico lettore,
Siamo una piccola squadra alla Techiescience, che lavora duro tra i grandi player. Se ti piace quello che vedi, condividi i nostri contenuti sui social media. Il tuo supporto fa una grande differenza. Grazie!