In questo articolo, "Struttura di Lewis dell'acido nitrico", procedura di disegno della struttura di Lewis, vengono discusse brevemente alcune proprietà con alcune spiegazioni dettagliate.
L'acido nitrico è fondamentalmente un composto ionico costituito da H+ e NO3- ione. Azoto e ossigeno hanno rispettivamente 7 e 8 elettroni. Tra questi, solo gli elettroni di valance sono mostrati attorno ai rispettivi atomi e il resto degli elettroni partecipa alla formazione del legame covalente.
La prospettiva principale di questo articolo è disegnare e analizzare la struttura a punti lewis dell'acido nitrico mostrata di seguito.
Cos'è la struttura di Lewis?
Struttura di Lewis o noto come struttura a punti lewis è un tipo di rappresentazione di qualsiasi molecola con gli elettroni del guscio di mantovana attorno alle rispettive specie e i legami attaccati con gli atomi.
Struttura del punto di Lewis è stato chiamato per la prima volta dal nome dell'eminente scienziato Gilbert. N.Lewis. Lo ha introdotto per la prima volta struttura legislativa concetto nel suo articolo intitolato "L'atomo e la molecola" nell'anno 1916.
Struttura di Lewis in realtà aiuta a determinare la struttura, il numero di elettroni che partecipano al legame o alla formazione covalente e gli elettroni rimangono come coppie non legate. Questi sono tutti mostrati in struttura legislativa. Dà anche una via d'uscita per calcolare la carica formale di ciascuno degli atomi in una particolare specie molecolare.
Processo di disegno della struttura di Lewis
Ci sono alcuni punti che devono essere seguiti disegnare la struttura di lewis che sono spiegati di seguito-
- Verranno calcolati per primi i numeri atomici e il numero di elettroni di mantovana di ciascuna specie.
- Numero di elettroni per riempire l'ottetto o gli elettroni necessari per riempire il guscio di mantovana di quella specie contati per ogni atomo a disegnare la struttura di lewis.
- Dovrebbe essere determinato anche il numero di legami covalenti o ionici presenti in quella molecola.
- Dopo aver determinato i parametri di cui sopra, verranno disegnate le strutture scheletriche della molecola che mostrano gli elettroni del guscio di mantovana ei legami presenti nella molecola.

In questo sopra struttura legislativa di anidride carbonica, gli elettroni non legati dell'ossigeno sono mostrati attorno agli atomi di ossigeno. Ha un totale di otto elettroni e configurazione elettronica è 1s2 2s2 2p4. L'elettrone di mantovana totale è sei. Tra questi sei elettroni, due elettroni partecipano alla formazione del legame covalente con il carbonio. Il resto dei quattro elettroni è mostrato come elettroni non legati attorno a ciascuno dei due atomi di ossigeno.
Il carbonio ha numero atomico sei con configurazione elettronica 1s2 2s2 2p2. Pertanto, ha quattro elettroni più esterni del guscio e tutti gli elettroni di valance vengono utilizzati per formare i quattro legami covalenti con due atomi di ossigeno. Quindi, nessun elettrone viene mostrato attorno agli atomi di carbonio.
Struttura di Lewis dell'acido nitrico
L'acido nitrico, noto come aqua fortis (inglese che significa acqua forte) è un acido inorganico molto forte che ha massa molare 63.012 g/mol e densità 1.41 g/cm3. Il struttura legislativa di acido nitrico può anche essere prelevato utilizzando i metodi spiegati sopra.

L'acido nitrico contiene tre tipi di atomi, idrogeno, ossigeno e azoto. L'ossigeno e l'azoto hanno rispettivamente otto e sei elettroni. L'ossigeno ha un totale di sei elettroni nel suo guscio più esterno e l'azoto ha cinque elettroni nel suo guscio più esterno.
Gli atomi di ossigeno sono indicati rispettivamente come 1,2,3. Tra questi elettroni, l'ossigeno numero 1 indicava i suoi quattro elettroni (tra 8 elettroni di mantovana) in formazione di legami covalenti con azoto e idrogeno. Un caso simile si osserva anche per il numero 3 indicato con ossigeno. Ma uno scenario diverso è per il numero 2 indicato con ossigeno. In questo ossigeno, sei elettroni sono mostrati come non legati attorno agli atomi di ossigeno e diventano negativi.
L'azoto ha cinque elettroni nel suo guscio di mantovana e usa i suoi quattro di questi cinque elettroni del guscio più esterni in formazione di legami con tre atomi di ossigeno e diventa +1.
Calcolo formale della carica dell'acido nitrico
La carica formale di ciascuno degli atomi in un'intera specie molecolare può essere calcolata usando la seguente formula:
- Carica formale = numero totale di elettroni di mantovana – numero di elettroni che rimangono non legati – (numero di elettroni coinvolti nella formazione del legame/2)
- Addebito formale sul numero 1 e sul numero 3 indicava ossigeno = 6 – 4 – (4/2) = 0
- La carica formale del numero 2 indicava ossigeno = 6 – 6 – (2/2) = -1
- Carica formale sull'azoto = 5 – 0 – (8/2) = +1
- Carica formale sull'idrogeno = 1 – 0 – (2/2) = 0
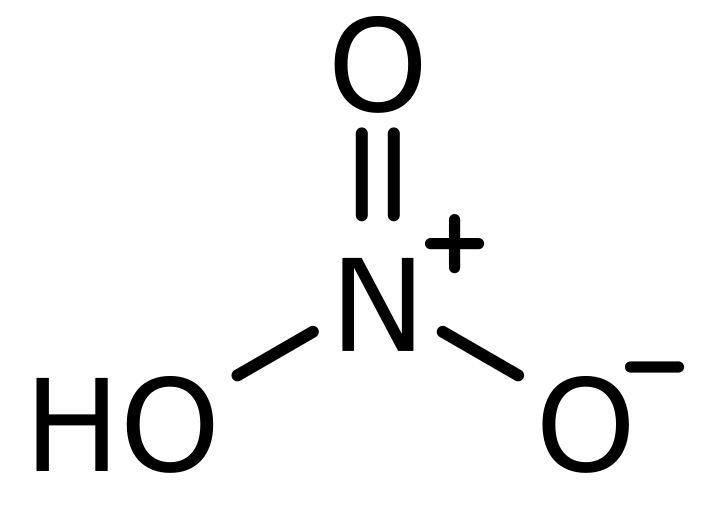
Immagine di credito: Wikimedia Commons
Domande frequenti (FAQ)
L'acido nitrico reagisce con l'acqua?
Risposta: L'acido nitrico si decompone in acqua si decompone in biossido di azoto (NO2), ossigeno (O2) e la soluzione risultante assume un colore giallastro.
HNO3 = NO2 + O2 + H2O
L'acido nitrico reagisce con il metallo?
Risposta: L'acido nitrico reagisce con il metallo e libera gas idrogeno (H2). Dopo aver reagito con l'acido nitrico il magnesio (Mg) forma nitrato di magnesio [Mg (NO3)2] e idrogeno gassoso.
Mg+HNO3 = Mg (NO3)2 + H2
Leggi anche:
- Struttura di Lewis dell'acido acetico
- Na2so4 struttura lewis
- Struttura di Seo2 Lewis
- Hio3 struttura lewis
- Struttura di Lewis Hpo4
- Brcl5 struttura lewis
- Struttura di Lewis di Mg2
- Nessuna struttura Lewis
- Struttura di Lewis Nh2f
- Struttura di Lewis Al3

Ciao,
Sono Aditi Ray, una PMI chimica su questa piattaforma. Ho completato la laurea in Chimica presso l'Università di Calcutta e la laurea presso la Techno India University con una specializzazione in Chimica Inorganica. Sono molto felice di far parte della famiglia Lambdageeks e vorrei spiegare l'argomento in modo semplicistico.
Colleghiamoci tramite LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202
