L'esempio di reazione non spontanea è quello in cui la generazione del prodotto non è promossa nelle condizioni date. Una reazione deve essere endotermica e accompagnata da un calo di entropia per non essere spontanea.
Diamo un'occhiata agli esempi qui sotto-
Scioglimento del ghiaccio esempi di reazioni non spontanee
La fusione del ghiaccio è un processo non spontaneo perché nel ghiaccio le molecole sono molto ben impacchettate, la ragione principale di ciò è la presenza di H, un legame, e quindi il ghiaccio ha una bassa entropia. Quando il ghiaccio si scioglie, la forza intermolecolare si rompe e anche l'ordine viene interrotto, quindi ci sarà un improvviso cambiamento nell'entropia. La condizione principale di una reazione non spontanea è che ci sarà un cambiamento improvviso nell'entropia, quindi la reazione ha detto che non è spontanea.
2H2O → 2H2 + O2
Acqua Idrogeno + ossigeno
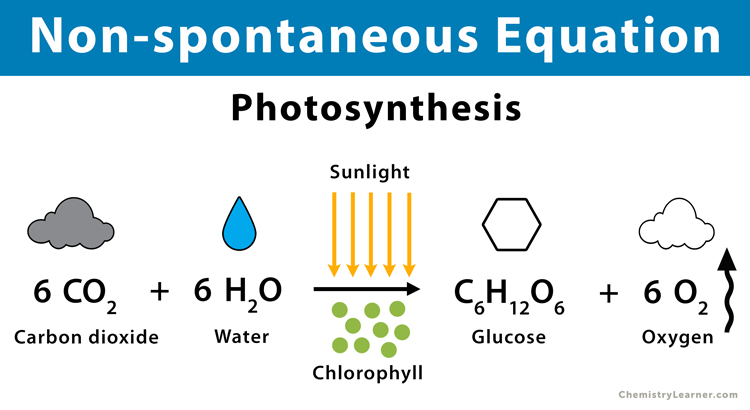
Reazione della fotosintesi
Poiché la fotosintesi è costituita da una sequenza di processi chimici non spontanei, è un sistema di non equilibrio. Il processo totale è endotermico (H > 0), con una diminuzione dell'entropia del sistema (S < 0) e un'energia libera di Gibbs positiva (G > 0).
Poiché l'energia del sole o della luce solare viene assorbita durante il processo di fotosintesi, si parla di reazione endotermica.
6CO2 + 6 ore2O → C2H12O6 + 6O2
Anidride carbonica + acqua (clorofilla) Glucosio Ossigeno
Combustione di metano
La combustione esotermica di molecole organiche come il metano è un processo non spontaneo. Per avviare il processo è necessaria una fiamma o una scintilla. Per questo motivo, la combustione del metano è una reazione non spontanea.
CH4 + H2O → CO2 + 2 ore2O
Metano + Acqua dà anidride carbonica + acqua
La nostra atmosfera è costituita da una miscela di azoto e ossigeno gassoso e questa risposta forma protossido di azoto. Questa reazione non è spontanea a temperatura e pressione normali, è altamente endotermica e si verifica un cambiamento leggermente positivo.
- Formazione di monossido di azoto
- La nostra atmosfera è costituita da una miscela di azoto e ossigeno gassoso e questa risposta forma protossido di azoto. Questa reazione non è spontanea a temperatura e pressione normali, è altamente endotermica e ha luogo un cambiamento leggermente positivo.
N2 + O2 → 2NO
Azoto Ossigeno Monossido di azoto
Elettrolisi dell'acqua:
L'energia elettrica all'interno della forma di energia è fornita con acqua (H2O), che si decompone in idrogeno (H2) e ossigeno (O2). Questo sistema è chiamato elettrolisi ed è a reazione redox
2 H2O (l) → 2 H2 (g)+ O2 (G)
Formazione di ozono:
Conversione di ossigeno (O2) A ozono (O3) è un metodo non spontaneo in alcun modo rispetto alle temperature. Viene spinto tramite mezzi di raggi ultravioletti (hν) blandi dal sole.
A proposito di 32 (g) + hν → 2 O3 (G)
Reazione della cella elettrolitica
Mentre le celle elettrolitiche contengono reazioni non spontanee e di conseguenza richiedono un'alimentazione di elettroni esterna come una batteria CC o un'alimentazione di energia CA. Poiché gli elettroni galleggiano da esso, l'anodo in un molecolare elettrolitico è positivo, mentre il catodo è terribile mentre gli elettroni lo fanno circolare. In un molecolare elettrolitico, viene eseguita una tensione esterna per esercitare una pressione su una reazione non spontanea.
Leggi di più su Proprietà del legame peptidico: fatti dettagliati e analisi comparativa
Come capire se una reazione è non – spontanea o no?
Se l'energia libera di Gibbs è negativa, allora il la reazione è spontanea, e se è positivo, allora non è istantaneo.
Significato della reazione non spontanea
Una tecnica spontanea è quella che avviene sicuramente al di sotto di condizioni positive. Una tecnica non spontanea, d'altra parte, ora non si avvicinerà più fino a quando non verrà "guidata" con l'ausilio dell'ingresso cronico di elettricità da una fonte esterna.
Se H e S sono entrambi negativi, la reazione è spontanea solo a basse temperature. Poiché il termine di entropia è una quantità positiva inferiore alle basse temperature, è più probabile che l'entalpia negativa guidi la spontaneità della reazione.
Ciao….mi chiamo Niviya Rajan, ho completato il mio Master in Chimica. Mi piace sempre esplorare nuove aree nel campo della Chimica. A parte questo, mi piace leggere e viaggiare.
