Il tetrafluoruro di silicio (SiF4) ha un atomo centrale di silicio (Si) con 4 elettroni di valenza, che forma legami singoli con quattro atomi di fluoro (F), ciascuno dei quali contribuisce con 7 elettroni di valenza. La struttura di Lewis mostra quattro legami Si-F e nessuna coppia solitaria sul silicio, utilizzando 8 elettroni di legame. SiF4 adotta una geometria tetraedrica con angoli di legame di circa 109.5°, caratteristica dell'ibridazione sp³. La molecola non è polare a causa della sua forma simmetrica, nonostante l'elevata elettronegatività del fluoro (3.98). Questa struttura e la forza dei legami Si-F influenzano in modo significativo le proprietà chimiche del SiF4, compresa la sua reattività e il ruolo nell'industria dei semiconduttori.

Discutiamo il seguente punto in questo articolo
- come disegnare la struttura di lewis per SIF4
- SIF4 lewis struttura coppie solitarie
- SIF4 forma della struttura lewis
- SIF4 regola dell'ottetto della struttura lewis
- Ibridazione SIF4
- SIF4 risonanza della struttura di lewis
- SIF4 polare o non polare
- SIF4 lewis struttura oneri formali
- SIF4 forma della struttura lewis
come disegnare la struttura di lewis per SIF4
La forma di una molecola dipende dalla repulsione tra la coppia di legami elettronici di valenza o la coppia di non legame. Nella molecola SIF4, i quattro atomi di fluoro sono circondati da un atomo di silicio centrale. L'atomo di silicio ha quattro elettroni spaiati,
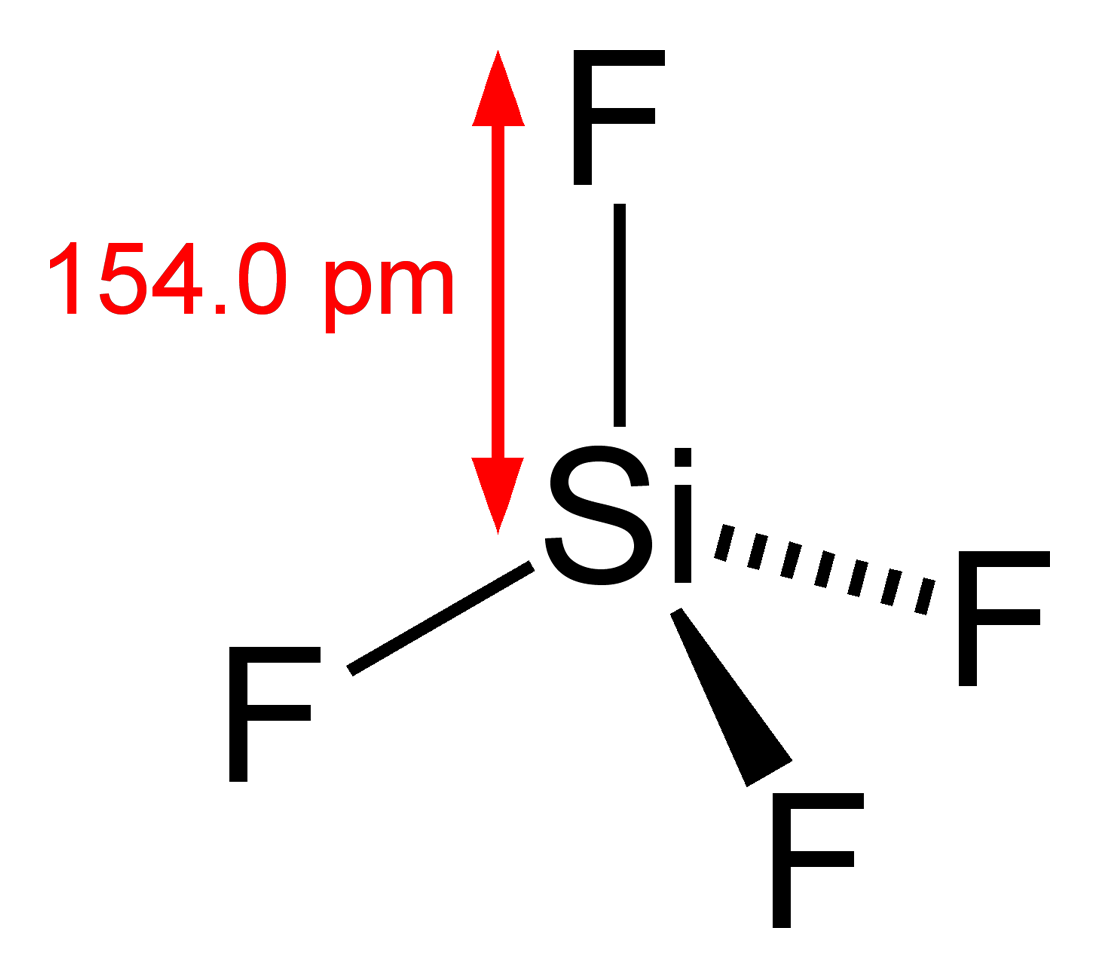
Secondo la regola dell'ottetto, il silicio è accoppiato con altri quattro atomi per completare il suo ottetto. Quindi formano quattro legami Si-F. Secondo la teoria VSEPR, la molecola SiF4 mostra una geometria tetraedrica, con un angolo di legame di 109.5o e durata dell'obbligazione di 154 pm.
SIF4 lewis struttura coppie solitarie
Elettrone di valenza di un atomo di silicio= 4×1=4
Elettrone di valenza di quattro atomi di fluoro = 7×4=28
Elettroni di valenza totali = 32 ci sono 16 coppie di elettroni richieste per una stalla Struttura di Lewis.
Nel totale della struttura sopra, abbiamo 16 coppie di elettroni con quattro legami Si-F Quindi rimangono 12 elettroni che sono indicati da coppie solitarie, per ogni atomo di fluoro ci sono tre coppie solitarie quindi sono presenti un totale di 12 coppie solitarie di elettroni attorno al silicio atomo,
e il silicio ha zero coppie di elettroni perché tutte le 12 coppie di elettroni sono presenti attorno ai quattro atomi di fluoro.
SIF4 forma della struttura lewis

SIF4 regola dell'ottetto della struttura lewis
Nel sopra Struttura di Lewis, silicio e fluoro non hanno alcuna carica e l'atomo di silicio centrale completa il suo ottetto quindi questa struttura è una struttura di Lewis stabile. Per una struttura di Lewis stabile, tutti gli atomi nelle molecole presenti devono soddisfare la regola dell'ottetto,
la regola dell'ottetto afferma che per ottenere una configurazione stabile il guscio di valenza di un atomo contiene otto elettroni che assomigliano a una configurazione elettronica del gas nobile più vicino.
Nella molecola SiF4, l'atomo di fluoro richiede un solo elettrone per completare il suo ottetto mentre l'atomo di silicio richiede quattro elettroni per completare il suo ottetto e diventare stabile. l'atomo di silicio e fluoro condivide un elettrone tra loro e completa il loro ottetto, l'idrogeno ha due elettroni di valenza e il silicio ha otto elettroni di valenza in questo modo completano il loro ottetto.
Ibridazione SIF4
L'ibridazione è un processo in cui gli orbitali atomici di entrambi gli atomi in una molecola si uniscono e si combinano tra loro per formare un orbitale ibrido sovrapponendo direttamente un legame sigma mentre i paralleli laterali si sovrappongono formando un legame pi.
Nella molecola di SiH4 la configurazione elettronica del silicio è,
Si: 1s2 2s2 2p6 3s2 3p2
Si: [Ar] 3s2 3p2

Dal diagramma sopra, l'orbitale s e l'orbitale tre p si uniscono e si combinano per formare 4 3p ibridi3 orbitali questi 4 orbitali ibridi formano quattro legami sigma con quattro atomi di idrogeno. Pertanto, l'ibridazione per Si è sp3 in SiH4.
SIF4 risonanza della struttura di lewis
La risonanza è un fenomeno chimico in cui le intere proprietà della molecola non sono in grado di spiegarsi con un'unica struttura. Ci sono molte strutture canoniche coinvolte. Ma non tutte le molecole possono esibire risonanza.
SiF4 struttura legislativa non esibisce risonanza perché non c'è delocalizzazione degli elettroni e c'è la presenza di legami singoli. Quindi non c'è movimento. Anche se c'è la presenza di coppie solitarie di elettroni, la delocalizzazione disturba il fattore di stabilità. Quindi non ci sono risonanti strutture del SiFl4 lewis La struttura
SIF4 polare o non polare
I quattro atomi di fluoro sono circondati da un atomo di silicio centrale nella molecola SiF4, l'elettronegatività dell'atomo di silicio è 1.90 e quella di elettronegatività dell'atomo di fluoro è 3.98 la differenza tra l'elettronegatività del fluoro e del silicio è 2.08,
questa differenza di elettronegatività tra silicio e fluoro indica che le coppie di elettroni sono fortemente attratte dall'atomo di fluoro, quindi il legame Si-F nella molecola SiF4 è polare. la maggiore differenza di elettronegatività tra loro indica che la coppia di elettroni è fortemente attratta dall'atomo di fluoro, quindi il legame Si-F è altamente polare.
SIF4 lewis struttura oneri formali
Nella molecola di tetrafluoruro di silicio il numero di cariche effettive corrisponde alle cariche formali totali. Gli oneri formali sono calcolati dal SiF4 Struttura a punti di Lewis. Che sono calcolati con la seguente formula,
La carica formale sull'atomo di Si della molecola di SiF4 = elettrone di valenza della coppia Silone di silicio -1/2 (coppia di elettroni di legame)
Secondo la formula formale di calcolo della carica, l'atomo di silicio ha 4 elettroni di valenza, otto elettroni di legame e nessuna coppia solitaria. quindi , Nella molecola di SiF4 Pertanto, carica formale sull'atomo di silicio della molecola di SiF4 = (4- 0-(8/2)) =0
Quindi le cariche formali nella molecola di SiF4 sono zero.
SIF4 forma della struttura lewis
Struttura tetraedrica di SiF4 mostrata di seguito:
Domande frequenti
Qual è la struttura di Lewis di SiF4?
Risposta: Nel Struttura di Lewis dell'atomo di silicio centrale della molecola SiF4 è circondato da quattro atomi di fluoro, forma quattro legami Si-F, tutti gli atomi di fluoro hanno tre coppie solitarie su ciascuno.
Quali sono le somiglianze e le differenze tra le strutture di Lewis di XeO3 e SIF4?
I Spiegazione della struttura di xeo3 lewis rivela che sia XeO3 che SiF4 hanno atomi centrali circondati da coppie di elettroni e coppie di legami. Tuttavia, la differenza fondamentale risiede nel numero di coppie di elettroni e negli angoli di legame. XeO3 ha 3 coppie di legami e 2 coppie solitarie, risultando in una forma piramidale trigonale con angoli di legame di circa 109.5°. D'altra parte, SiF4 ha 4 coppie di legami e nessuna coppia solitaria, conferendogli una forma tetraedrica con angoli di legame di 109.5°.
Come si fa a prevedere la forma di SiF4?
Risposta: La forma di SiF4 è prevista dalla teoria VSEPR, l'atomo centrale di silicio ha quattro elettroni di valenza quindi è attaccato a quattro atomi di fluoro e forma una geometria tetraedrica.
Qual è il significato della struttura di Lewis?
Risposta: Definisce la natura del legame e la posizione degli atomi della molecola che sono collegati nella molecola. La rappresentazione delle molecole nella struttura a punti elettronici di Lewis o semplicemente in una struttura di Lewis è in onore del chimico americano Gilbert Newton Lewis.
Leggi anche:
- Struttura di Lewis Ncl2
- Struttura di Lewis Co2
- Struttura di Bao Lewis
- Struttura di Lewis Sncl2
- Struttura di Lewis H2so4
- Struttura di Lewis Xecl2
- Struttura di Lewis Chf3
- Na2so4 struttura lewis
- Bf3 struttura di Lewis
- Struttura di Lewis dell'H2o2

Ciao….Sono Darshana Fendarkar, ho completato il mio dottorato di ricerca. dell'Università di Nagpur. La mia area di specializzazione è la Chimica Inorganica.
Ho un'esperienza come chimico presso Earthcare Pvt. Ltd. Inoltre ho 2 anni di esperienza nell'insegnamento. Attualmente lavoro con Lambdageek come esperto in materia.


Ciao amico lettore,
Siamo una piccola squadra alla Techiescience, che lavora duro tra i grandi player. Se ti piace quello che vedi, condividi i nostri contenuti sui social media. Il tuo supporto fa una grande differenza. Grazie!